La dysplasie coxo-fémorale ou dysplasie de hanche
La dysplasie coxo-fémorale ou dysplasie de hanche
Par le Dr Jean-Marc Wurtz
La dysplasie coxo-fémorale, plus communément appelée dysplasie de la hanche, est une affections de l’appareil ostéo-articulaire particulièrement répandue dans l’espèce canine. Elle affecte préférentiellement les races de grande taille à croissance rapide.
La dysplasie résulte d’une malformation de l’un des composants de l’articulation. Une articulation est le point de rencontre entre deux os, unis entre eux par des ligaments, et destinés à être mobiles l’un par rapport à l’autre. Elle est entourée d’un manchon protecteur appelé capsule articulaire. Les surfaces osseuses en contact sont appelées surfaces articulaires et sont recouvertes d’un cartilage destiné à faciliter les mouvements des os entre eux, l’ensemble baignant dans un liquide appelé liquide synovial et qui fait office de lubrifiant.
Lorsqu’une articulation est dysplasique, les mouvements qui s’y effectuent sont soumis à des contraintes mécaniques anormales qui conduisent à une usure prématurée puis une destruction des cartilages et des extrémités osseuses aboutissant à la constitution de lésions d’arthrose. Celle-ci se traduit cliniquement par une douleur et une boiterie handicapant plus ou moins l’animal.
La dysplasie de la hanche est une maladie génétique et donc transmissibles à la descendance. Le premier traitement est préventif et consiste en un dépistage systématique des sujets atteints afin de les écarter des circuits de reproduction.
 Définition et généralités.
Définition et généralités.
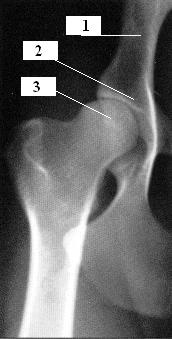
L’articulation coxo-fémorale unit le fémur à l’os coxal, ce volumineux os qui forme le bassin. L’os coxal est creusé d’une cavité appelée cotyle, dans laquelle s’emboîte complètement la tête du fémur qui est fixée au fond du cotyle par un ligament unique appelé ligament rond. Cette articulation est entourée d’une capsule très épaisse.
1 – Os coxal.
2 – Cotyle.
3 – Tête du fémur.
Le point de départ de la maladie est une atteinte des ligaments et de la capsule dont le tissu constitutif, le collagène, voit sa structure chimique modifiée. Il en résulte ce que l’on appelle une hyper-laxité, c'est-à-dire un manque de fermeté du ligament rond et de la capsule. Tout se passe comme si ces deux éléments étaient trop longs, faisant que lors des mouvements du fémur, la tête de celui-ci ne reste pas à sa place au fond du cotyle mais a, en permanence, tendance à en sortir : on parle de mouvements de sub-luxation. Ce sont ces mouvements anormaux qui seront à l’origine des lésions observées et de l’arthrose handicapante.
Le mode de transmission génétique de cette maladie est très complexe et est dit « multi génique à seuil ». Multi génique signifie que plusieurs gènes sont concernés. La notion de seuil implique qu’il faut que le nombre de gènes présents chez l’animal et responsables de cette maladie soit supérieur à un certain total pour que l’animal soit atteint. Ensuite, ce seuil dépassé, plus il y aura de gènes nuisibles, plus le degré de la maladie ira en s’aggravant. Nous reviendrons à la génétique plus loin.
Influence des facteurs environnementaux.
A la génétique vient s’ajouter l’influence de certains facteurs dits environnementaux et qui sont principalement liés à l’hygiène de vie des chiots pendant leur croissance. Dans un lot de plusieurs chiens porteurs du potentiel génétique faisant d’eux des sujets dysplasiques, les lésions d’arthrose et donc l’intensité de la manifestation clinique de la maladie présentera une grande variabilité entre ces individus et ce, du fait de l’influence de ces facteurs environnementaux. Certains seront gravement invalidés dès leur jeune âge alors que d’autres ne manifesteront jamais aucune gêne avec, entre ces deux extrêmes, tous les stades intermédiaires possibles. De cette variabilité d’expression clinique découle le concept d’héritabilité.
L’héritabilité résulte d’un calcul mathématique statistique et détermine, pour une race donnée, l’influence que peuvent avoir les facteurs environnementaux. Si l’héritabilité est de 0, la part génétique peut être totalement contrecarrée alors que si elle est de 1, les facteurs environnementaux ne peuvent avoir aucune influence. Cet indice a été établi pour de nombreuses races. Elle est estimée par exemple entre 0,35 et 0,6 chez le Labrador, 0,3-0,45 chez le Leonberg, 0,26-0,39 chez le Rottweiler et 0,8 chez le Samoyede.
Parmi les facteurs environnementaux on retiendra:
Cette notion d’héritabilité explique aussi toute l’influence que peuvent avoir, pendant les premières semaines de vie chez l’éleveur, les règles hygiéno-diététiques auxquelles sont soumis les chiots.
Procédure de dépistage officielle.
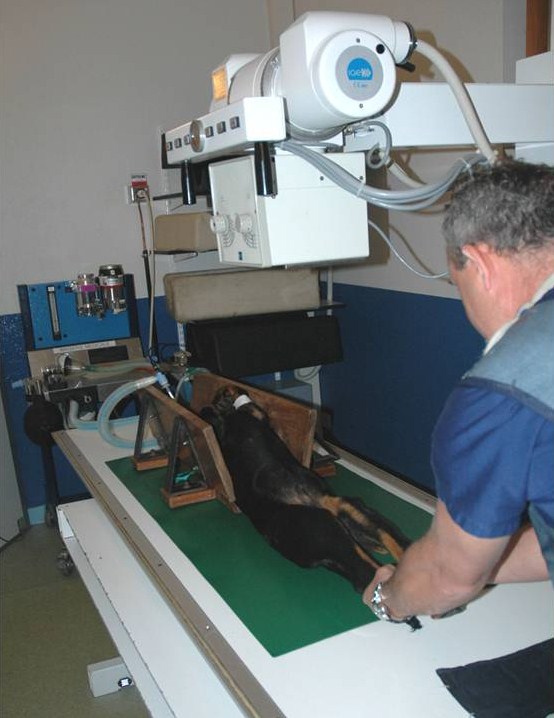
Le seul moyen de dépistage reconnu à ce jour par les instances cynophiles est la radiographie du bassin de face, réalisée obligatoirement sous anesthésie générale après l’âge de 12 mois. La position du chien pendant cet examen est d’une importance capitale : chien couché sur dos bassin parfaitement à plat, avec les membres postérieurs en traction, les deux fémurs devant être strictement parallèles avec les rotules bien centrées sur les fémurs (on dit que les rotules sont au zénith)
 Pourquoi l’anesthésie générale est-elle obligatoire ?Cotation officielleAvec anesthésieSans anesthésie
Pourquoi l’anesthésie générale est-elle obligatoire ?Cotation officielleAvec anesthésieSans anesthésie
A67.35%79.78%
B10.70%10.56%
C11.86%6.14%
D8.01%2.77%
E2.08%0.75%
Elle seule permet réellement d’obtenir les conditions nécessaires à la réalisation de clichés conformes aux critères de qualité exigés. Par ailleurs, de nombreuses études ont clairement montrées que l’absence d’anesthésie faussait les résultats du cliché de dépistage. En effet, un chien non anesthésié, même s’il est calme et docile, va conserver un tonus musculaire qui va « pousser » la tête du fémur dans le cotyle et donc masquer partiellement une hyperlaxité. A titre d’exemple, voici les résultats d’une étude menée sur un groupe de 11 000 chiens de différentes races.
On voit clairement dans le tableau ci-contre que le fait de réaliser le cliché de dépistage sans anesthésie majore nettement le taux de chiens indemnes et réduit significativement le taux des chiens cotés C, D ou E. De ce fait, la réalisation de l’examen sous anesthésie a été rendue obligatoire. Les chiens soumis au dépistage de la dysplasie sont des animaux jeunes, le plus souvent en bonne santé. Dans une telle population d’animaux, le risque anesthésique est tout à fait négligeable comparativement aux autres causes de mortalité accidentelle. A titre de repère, le risque anesthésique d’un sujet en bonne santé est chiffré à 1 sur 500 000 en anesthésie humaine.
En France, la lecture des clichés prend en compte l’aspect anatomique de l’articulation et de la mesure de l’angle de Norberg-Olsson. Concernant l’anatomie de la hanche, on recherche des signes d’usure précoce des surfaces articulaires et l’on apprécie la bonne position de la tête du fémur dans le cotyle (on parle de recouvrement cotyloidien). Les surfaces articulaires doivent être bien régulières, l’espace qui les sépare régulier et les têtes fémorales complètement recouvertes par le cotyle. Idéalement l’angle de Norberg-Olsson est supérieur à 105°. Les chiens seront alors répartis en cinq classes allant de A, chien totalement indemne de dysplasie à E, dysplasie sévère.
Il est recommandé de n’utiliser pour la reproduction que des animaux classés A ou B et d’écarter du circuit de la reproduction les sujets cotés C, D et E.GradeSignes observés.
Grade AAucune atteinte de l’articulation. Position tête fémur/cotyle parfaite.
Angle Norberg-Olsson supérieur à 105°.
Grade BStade intermédiaire.
Position tête fémorale/cotyle mauvaise et angle Norberg-Olsson supérieur à 105°.
Ou bonne position tête fémorale mais angle Norberg-Olsson compris entre 100 et 105°.
Grade CDysplasie légère.
Mauvaise position tête fémorale/cotyle et angle Norberg-Olsson compris entre 100 et 105°.
Grade DDysplasie moyenne.
Signes d’arthrose.
Mauvaise position tête fémorale/cotyle et angle Norberg-Olsson compris entre 90 et 100°.
Grade EDysplasie grave ;
Signes d’arthrose.
Mauvaise position tête fémorale/cotyle et angle Norbeg-Olsson inférieur à 90°.
Retour sur l’aspect génétique de cette maladie.
Nous l’avons dit, son mode de transmission est appelé multi génique à seuil. Chez le chien, comme tout être vivant, les gènes vont par paire, une moitié héritée du père, l’autre de la mère. La recombinaison entre les gènes issus de chacun des parents se fait lors de la fécondation et de façon tout à fait aléatoire et pouvant être d’une extrême variabilité entre les différents chiots d’une même portée. Malgré les progrès en génétique dans l’espèce canine, les gènes responsables de la dysplasie ne sont pour l’heure pas connus et ne le seront peut-être jamais. Et même si on les connaissait, le seul fait d’étudier les gènes de chacun des deux parents ne permettrait pas de conclure quand au risque de dysplasie de leur descendance tant ce mode de transmission est complexe. On peut cependant, en simplifiant à l’extrême, prévoir que plus il ya de gènes nuisibles chez les parents, plus le risque de dysplasie est élevé au sein de leur descendance. D’où la non utilisation de reproducteurs cotés D ou E. Certains clubs de race autorisent l’utilisation de reproducteurs cotés C sous réserve que ces derniers soient croisés avec un chien coté A. L’inverse n’est pas toujours aussi évident. Bien sûr, moins il y a de gènes délétères chez les parents, plus les chances de produire des chiots sains augmente, mais sans totale certitude. Prenons deux parents jugés indemnes après dépistage. Le nombre de gènes délétères chez chacun des parents est inférieur au seuil mais après la recombinaison opérée au cours de la fécondation, en fonction de la répartition des gènes chez les chiots, de l’addition des gènes délétères transmis par la mère et de ceux transmis par le père, le seuil fatidique pourra être dépassé chez certains d’entre eux. Ceci explique que l’union entre deux parents A ou B, même s’il limite considérablement les risques, n’aboutit pas au risque zéro. Ceci explique donc qu’en raison de cette incertitude, la maîtrise des risques environnementaux doit être la règle chez tous les chiots pendant la croissance.
Le meilleur moyen actuellement de se prémunir contre cette pathologie est donc, d’une part de n’utiliser que des reproducteurs parfaitement sains, eux-mêmes issus de reproducteurs exempts, mais également, d’effectuer un contrôle a posteriori sur la descendance afin de se convaincre du patrimoine génétique des parents. Mais une perspective d’avenir est en train de se faire jour.
L’avenir : le dépistage précoce par mesure de l’indice de distraction.
La procédure officielle, en place depuis bientôt 40 ans et préconisé par les instances cynophiles à travers le monde, n’a pas permis de faire baisser significativement la fréquence de cette maladie car elle a des limites :
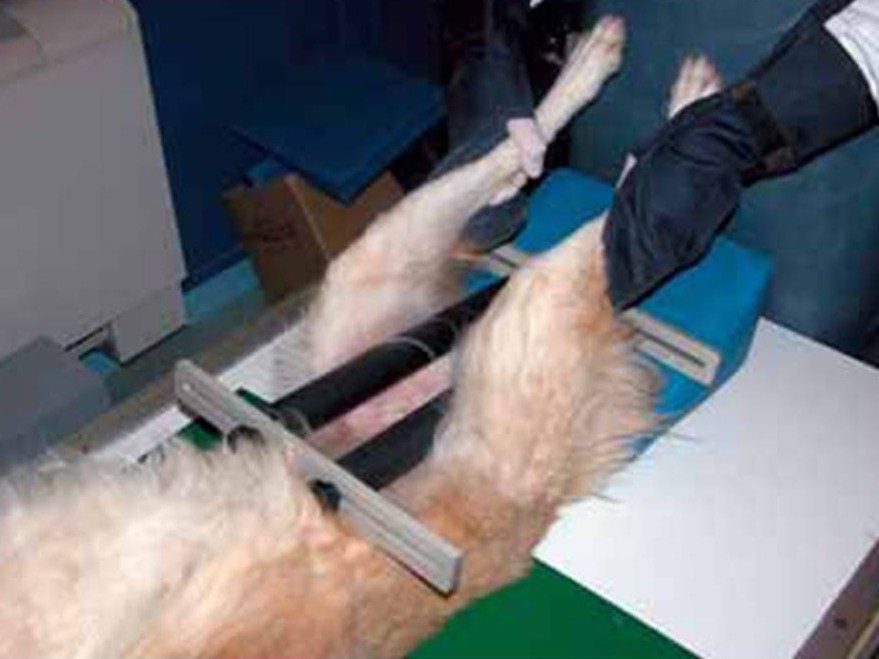 Dès 1983, le professeur Gail Smith, de l’université de Pennsylvanie, décrivait une technique radiologique permettant, dès l’âge de 4 mois, d’établir un indice objectif, mesurable et donc chiffrable, de la laxité de la hanche chez le chien : la méthode Pennhip (Pennsylvania hip improvement program). Cette méthode utilise un dispositif appelé « distracteur » et mesure une valeur appelée « l’indice de distraction ». Cette procédure repose sur la réalisation, en une seule séance et sous anesthésie, de 3 clichés radiologiques pratiqués chez un chien couché sur le dos : un cliché standard permettant d’évaluer l’aspect anatomique de l’articulation, et deux clichés en position forcée, l’un en compression et l’autre en « distraction » avec le distracteur placé entre les pattes arrières du chien, ces deux derniers clichés permettant de visualiser le degré d’étirement maximum des ligaments de la hanche et ainsi, de mesurer l’indice de distraction.
Dès 1983, le professeur Gail Smith, de l’université de Pennsylvanie, décrivait une technique radiologique permettant, dès l’âge de 4 mois, d’établir un indice objectif, mesurable et donc chiffrable, de la laxité de la hanche chez le chien : la méthode Pennhip (Pennsylvania hip improvement program). Cette méthode utilise un dispositif appelé « distracteur » et mesure une valeur appelée « l’indice de distraction ». Cette procédure repose sur la réalisation, en une seule séance et sous anesthésie, de 3 clichés radiologiques pratiqués chez un chien couché sur le dos : un cliché standard permettant d’évaluer l’aspect anatomique de l’articulation, et deux clichés en position forcée, l’un en compression et l’autre en « distraction » avec le distracteur placé entre les pattes arrières du chien, ces deux derniers clichés permettant de visualiser le degré d’étirement maximum des ligaments de la hanche et ainsi, de mesurer l’indice de distraction.
L’indice de distraction est calculé en mesurant le déplacement du centre de la tête fémorale entre le cliché en compression et celui en distraction. L’indice de distraction est mesuré séparément pour chaque hanche. Lorsque cet indice est de 0, l’emboitement de la tête fémorale dans le cotyle est parfait et il n’existe aucune hyper laxité. Un indice égal à 1 signe une luxation complète de la hanche. La laxité de la hanche mesurée par l’indice de distraction est un facteur prédictif de risque d’être atteint de DCF tout à fait fiable et ce, dès 4 mois, comme le prouvent différentes études dont l’une réalisée sur 15 742 chiens appartenant à différentes races prédisposées à cette maladie. Elle montre que le risque est en corrélation étroite avec la valeur de l’index. Ainsi, un chien dont l’indice est inférieur à 0,3 a un risque quasi nul d’être dysplasique alors qu’un chien dont l’indice dépasse 0,7 a un risque de 100% ! La procédure telle qu’elle est décrite, réduit à presque zéro le facteur lié à l’opérateur contrairement au dépistage classique. Elle a visiblement largement fait ses preuves aux Etats-Unis. Largement utilisée là-bas par les écoles de chiens guides d’aveugles sur leurs reproducteurs, ils ont réussi, sur une période de 8 ans, soit en moins de
5 générations, à abaisser leurs taux de dysplasie de 55% à 24% chez leurs Bergers Allemands et de 30% à 10% chez leurs Labradors.
Malheureusement, l’utilisation de cette procédure en dehors des Etats-Unis fut longtemps entravée car protégée par un brevet. Depuis peu, la procédure est tombée dans le domaine public et commence à se répandre y compris en France, mais sa reconnaissance par les instances cynophiles n’est pas encore d’actualité. Mais un jour viendra….. !
Traitement.
Nous l’avons dit, le meilleur traitement est préventif : dépistage des sujets atteints qui ne doivent pas être utilisés à la reproduction. Maîtrise des facteurs environnementaux chez tous les chiots pendant leur période de croissance.
La question du traitement curatif de cette pathologie ne se pose que chez un animal présentant des signes cliniques de la maladie c'est-à-dire une gêne fonctionnelle dans sa vie courante. La place respective du traitement médical et chirurgical est fonction de la gravité de l’atteinte clinique. Les techniques chirurgicales sont diverses et pouvant aller jusqu’à la mise en place d’une prothèse totale de la hanche. Sur ce point, mieux que quiconque, seul votre vétérinaire saura vous conseiller
Influence du cycle sexuel de la chienne sur le dépistage de la dysplasie de hanche.
Il est classique de croire que l’élévation du taux des œstrogènes chez la chienne pendant ses chaleurs était de nature à engendrer une fausse hyper laxité des ligaments de la hanche et donc de fausser le résultat de la radiographie de dépistage de la dysplasie de hanche et de croire que ce dépistage doit être fait à distance des chaleurs afin de ne pas s’exposer à voir les hanches de sa chienne être mal cotées à tort. Une étude américaine, réalisée par la même équipe que celle ayant mis au point la méthode Pennhip, datant du début des années 2000, semble bien mettre fin de façon claire à cette croyance. Les auteurs se sont intéressés à un groupe de 10 chiennes qu’ils ont suivies pendant toute la durée de leur cycle sexuel. Les différentes phases du cycle on été identifiées par l’étude répétée des frottis vaginaux. Pendant les chaleurs, des dosages hormonaux d’œstrogènes et de progestérone ont été réalisés. A chaque phase du cycle, un double dépistage de dysplasie a été effectué, par radiographie standard selon le protocole classique et par mesure de l’indice de distraction selon la méthode Pennhip. Les conclusions de cette première étude sont claires, les variations hormonales observées pendant les chaleurs ne modifient en rien le score de dysplasie que ce soit avec la méthode classique par radiographie standard ou le Pennhip.
Conclusions.
La dysplasie de hanche est une maladie génétique transmissible à la descendance. Source de destruction précoce plus ou moins sévère de l’articulation, les manifestations cliniques peuvent être très importantes et invalidantes. Il est donc indispensable de dépister les sujets atteints et de n’utiliser pour la reproduction que les sujets reconnus indemnes par le lecteur officiel de votre club de race. La méthode de dépistage actuellement admise par les instances cynophiles officielles, même si elle n’est pas parfaite, a cependant le mérite d’exister et de permettre de limiter la diffusion de cette maladie. Un nouveau mode de dépistage a vu le jour et se diffuse lentement chez nous. Il semble plus performant mais doit encore attendre sa reconnaissance officielle avant de pouvoir s’imposer.
Avec mes remerciements pour son aide précieuse au professeur J.P. Genevois de l’école vétérinaire de Lyon.
Source site Retriever Club de France
La dysplasie coxo-fémorale, plus communément appelée dysplasie de la hanche, est une affections de l’appareil ostéo-articulaire particulièrement répandue dans l’espèce canine. Elle affecte préférentiellement les races de grande taille à croissance rapide.
La dysplasie résulte d’une malformation de l’un des composants de l’articulation. Une articulation est le point de rencontre entre deux os, unis entre eux par des ligaments, et destinés à être mobiles l’un par rapport à l’autre. Elle est entourée d’un manchon protecteur appelé capsule articulaire. Les surfaces osseuses en contact sont appelées surfaces articulaires et sont recouvertes d’un cartilage destiné à faciliter les mouvements des os entre eux, l’ensemble baignant dans un liquide appelé liquide synovial et qui fait office de lubrifiant.
Lorsqu’une articulation est dysplasique, les mouvements qui s’y effectuent sont soumis à des contraintes mécaniques anormales qui conduisent à une usure prématurée puis une destruction des cartilages et des extrémités osseuses aboutissant à la constitution de lésions d’arthrose. Celle-ci se traduit cliniquement par une douleur et une boiterie handicapant plus ou moins l’animal.
La dysplasie de la hanche est une maladie génétique et donc transmissibles à la descendance. Le premier traitement est préventif et consiste en un dépistage systématique des sujets atteints afin de les écarter des circuits de reproduction.
 Définition et généralités.
Définition et généralités.L’articulation coxo-fémorale unit le fémur à l’os coxal, ce volumineux os qui forme le bassin. L’os coxal est creusé d’une cavité appelée cotyle, dans laquelle s’emboîte complètement la tête du fémur qui est fixée au fond du cotyle par un ligament unique appelé ligament rond. Cette articulation est entourée d’une capsule très épaisse.
1 – Os coxal.
2 – Cotyle.
3 – Tête du fémur.
Le point de départ de la maladie est une atteinte des ligaments et de la capsule dont le tissu constitutif, le collagène, voit sa structure chimique modifiée. Il en résulte ce que l’on appelle une hyper-laxité, c'est-à-dire un manque de fermeté du ligament rond et de la capsule. Tout se passe comme si ces deux éléments étaient trop longs, faisant que lors des mouvements du fémur, la tête de celui-ci ne reste pas à sa place au fond du cotyle mais a, en permanence, tendance à en sortir : on parle de mouvements de sub-luxation. Ce sont ces mouvements anormaux qui seront à l’origine des lésions observées et de l’arthrose handicapante.
Le mode de transmission génétique de cette maladie est très complexe et est dit « multi génique à seuil ». Multi génique signifie que plusieurs gènes sont concernés. La notion de seuil implique qu’il faut que le nombre de gènes présents chez l’animal et responsables de cette maladie soit supérieur à un certain total pour que l’animal soit atteint. Ensuite, ce seuil dépassé, plus il y aura de gènes nuisibles, plus le degré de la maladie ira en s’aggravant. Nous reviendrons à la génétique plus loin.
Influence des facteurs environnementaux.
A la génétique vient s’ajouter l’influence de certains facteurs dits environnementaux et qui sont principalement liés à l’hygiène de vie des chiots pendant leur croissance. Dans un lot de plusieurs chiens porteurs du potentiel génétique faisant d’eux des sujets dysplasiques, les lésions d’arthrose et donc l’intensité de la manifestation clinique de la maladie présentera une grande variabilité entre ces individus et ce, du fait de l’influence de ces facteurs environnementaux. Certains seront gravement invalidés dès leur jeune âge alors que d’autres ne manifesteront jamais aucune gêne avec, entre ces deux extrêmes, tous les stades intermédiaires possibles. De cette variabilité d’expression clinique découle le concept d’héritabilité.
L’héritabilité résulte d’un calcul mathématique statistique et détermine, pour une race donnée, l’influence que peuvent avoir les facteurs environnementaux. Si l’héritabilité est de 0, la part génétique peut être totalement contrecarrée alors que si elle est de 1, les facteurs environnementaux ne peuvent avoir aucune influence. Cet indice a été établi pour de nombreuses races. Elle est estimée par exemple entre 0,35 et 0,6 chez le Labrador, 0,3-0,45 chez le Leonberg, 0,26-0,39 chez le Rottweiler et 0,8 chez le Samoyede.
Parmi les facteurs environnementaux on retiendra:
- - La race joue un rôle indéniable et important. Le facteur racial s’exprime au travers de l’angle entre l’axe des membres postérieurs et la colonne vertébrale ainsi que par le degré de développement des muscles fessiers et plus précisément, leur masse relative par rapport à la masse corporelle totale. Ces deux facteurs sont certes en partie déterminés par les facteurs exercice physique et alimentation mais aussi, en tant que caractéristique d’une race donnée, par des facteurs génétiques différents de ceux impliqués dans le déterminisme de la dysplasie. Ce dernier point est actuellement retenu pour expliquer l’absence de dysplasie chez les différentes races de lévrier qui présentent tous une masse des muscles fessiers importante pour une masse corporelle totale faible.
- - L’alimentation est le facteur qui a donné lieu au plus grand nombre de travaux. Elle joue un rôle indiscutable et l’impact négatif d’une alimentation trop riche en protéines et en calcium pendant la période de croissance est aujourd’hui parfaitement reconnue. Allant dans le même sens, et en partie dépendant de l’alimentation, on citera aussi une prise de poids trop rapide et trop importante.
- - L’exercice physique a toujours été montré du doigt. Or aucune étude précise n’a jamais été réalisée sur ce point et son influence peut se discuter. La solution est celle du juste milieu. Un minimum d’exercice physique est nécessaire à l’obtention d’un bon développement musculaire notamment au niveau des muscles fessiers pour favoriser la stabilisation de l’articulation. Faire bouger le chiot et le muscler certes, mais en évitant, pendant la période de croissance tout effort forcé et prolongé, la montée et descente des escaliers et les sauts.
- - La castration précoce chez les mâles est pointée du doigt par un article récent.
Cette notion d’héritabilité explique aussi toute l’influence que peuvent avoir, pendant les premières semaines de vie chez l’éleveur, les règles hygiéno-diététiques auxquelles sont soumis les chiots.
Procédure de dépistage officielle.
Le seul moyen de dépistage reconnu à ce jour par les instances cynophiles est la radiographie du bassin de face, réalisée obligatoirement sous anesthésie générale après l’âge de 12 mois. La position du chien pendant cet examen est d’une importance capitale : chien couché sur dos bassin parfaitement à plat, avec les membres postérieurs en traction, les deux fémurs devant être strictement parallèles avec les rotules bien centrées sur les fémurs (on dit que les rotules sont au zénith)
 Pourquoi l’anesthésie générale est-elle obligatoire ?Cotation officielleAvec anesthésieSans anesthésie
Pourquoi l’anesthésie générale est-elle obligatoire ?Cotation officielleAvec anesthésieSans anesthésieA67.35%79.78%
B10.70%10.56%
C11.86%6.14%
D8.01%2.77%
E2.08%0.75%
Elle seule permet réellement d’obtenir les conditions nécessaires à la réalisation de clichés conformes aux critères de qualité exigés. Par ailleurs, de nombreuses études ont clairement montrées que l’absence d’anesthésie faussait les résultats du cliché de dépistage. En effet, un chien non anesthésié, même s’il est calme et docile, va conserver un tonus musculaire qui va « pousser » la tête du fémur dans le cotyle et donc masquer partiellement une hyperlaxité. A titre d’exemple, voici les résultats d’une étude menée sur un groupe de 11 000 chiens de différentes races.
On voit clairement dans le tableau ci-contre que le fait de réaliser le cliché de dépistage sans anesthésie majore nettement le taux de chiens indemnes et réduit significativement le taux des chiens cotés C, D ou E. De ce fait, la réalisation de l’examen sous anesthésie a été rendue obligatoire. Les chiens soumis au dépistage de la dysplasie sont des animaux jeunes, le plus souvent en bonne santé. Dans une telle population d’animaux, le risque anesthésique est tout à fait négligeable comparativement aux autres causes de mortalité accidentelle. A titre de repère, le risque anesthésique d’un sujet en bonne santé est chiffré à 1 sur 500 000 en anesthésie humaine.
En France, la lecture des clichés prend en compte l’aspect anatomique de l’articulation et de la mesure de l’angle de Norberg-Olsson. Concernant l’anatomie de la hanche, on recherche des signes d’usure précoce des surfaces articulaires et l’on apprécie la bonne position de la tête du fémur dans le cotyle (on parle de recouvrement cotyloidien). Les surfaces articulaires doivent être bien régulières, l’espace qui les sépare régulier et les têtes fémorales complètement recouvertes par le cotyle. Idéalement l’angle de Norberg-Olsson est supérieur à 105°. Les chiens seront alors répartis en cinq classes allant de A, chien totalement indemne de dysplasie à E, dysplasie sévère.

Il est recommandé de n’utiliser pour la reproduction que des animaux classés A ou B et d’écarter du circuit de la reproduction les sujets cotés C, D et E.GradeSignes observés.
Grade AAucune atteinte de l’articulation. Position tête fémur/cotyle parfaite.
Angle Norberg-Olsson supérieur à 105°.
Grade BStade intermédiaire.
Position tête fémorale/cotyle mauvaise et angle Norberg-Olsson supérieur à 105°.
Ou bonne position tête fémorale mais angle Norberg-Olsson compris entre 100 et 105°.
Grade CDysplasie légère.
Mauvaise position tête fémorale/cotyle et angle Norberg-Olsson compris entre 100 et 105°.
Grade DDysplasie moyenne.
Signes d’arthrose.
Mauvaise position tête fémorale/cotyle et angle Norberg-Olsson compris entre 90 et 100°.
Grade EDysplasie grave ;
Signes d’arthrose.
Mauvaise position tête fémorale/cotyle et angle Norbeg-Olsson inférieur à 90°.
Retour sur l’aspect génétique de cette maladie.
Nous l’avons dit, son mode de transmission est appelé multi génique à seuil. Chez le chien, comme tout être vivant, les gènes vont par paire, une moitié héritée du père, l’autre de la mère. La recombinaison entre les gènes issus de chacun des parents se fait lors de la fécondation et de façon tout à fait aléatoire et pouvant être d’une extrême variabilité entre les différents chiots d’une même portée. Malgré les progrès en génétique dans l’espèce canine, les gènes responsables de la dysplasie ne sont pour l’heure pas connus et ne le seront peut-être jamais. Et même si on les connaissait, le seul fait d’étudier les gènes de chacun des deux parents ne permettrait pas de conclure quand au risque de dysplasie de leur descendance tant ce mode de transmission est complexe. On peut cependant, en simplifiant à l’extrême, prévoir que plus il ya de gènes nuisibles chez les parents, plus le risque de dysplasie est élevé au sein de leur descendance. D’où la non utilisation de reproducteurs cotés D ou E. Certains clubs de race autorisent l’utilisation de reproducteurs cotés C sous réserve que ces derniers soient croisés avec un chien coté A. L’inverse n’est pas toujours aussi évident. Bien sûr, moins il y a de gènes délétères chez les parents, plus les chances de produire des chiots sains augmente, mais sans totale certitude. Prenons deux parents jugés indemnes après dépistage. Le nombre de gènes délétères chez chacun des parents est inférieur au seuil mais après la recombinaison opérée au cours de la fécondation, en fonction de la répartition des gènes chez les chiots, de l’addition des gènes délétères transmis par la mère et de ceux transmis par le père, le seuil fatidique pourra être dépassé chez certains d’entre eux. Ceci explique que l’union entre deux parents A ou B, même s’il limite considérablement les risques, n’aboutit pas au risque zéro. Ceci explique donc qu’en raison de cette incertitude, la maîtrise des risques environnementaux doit être la règle chez tous les chiots pendant la croissance.
Le meilleur moyen actuellement de se prémunir contre cette pathologie est donc, d’une part de n’utiliser que des reproducteurs parfaitement sains, eux-mêmes issus de reproducteurs exempts, mais également, d’effectuer un contrôle a posteriori sur la descendance afin de se convaincre du patrimoine génétique des parents. Mais une perspective d’avenir est en train de se faire jour.
L’avenir : le dépistage précoce par mesure de l’indice de distraction.
La procédure officielle, en place depuis bientôt 40 ans et préconisé par les instances cynophiles à travers le monde, n’a pas permis de faire baisser significativement la fréquence de cette maladie car elle a des limites :
- - Elle est très « opérateur dépendante », la moindre erreur de positionnement du chien pouvant modifier significativement le résultat de la procédure.
- - La détermination du score est très subjective. Il existe une grande variabilité de l’interprétation des clichés radiologiques entre les différents lecteurs.
- - L’héritabilité : la radiographie de dépistage standard n’a de valeur qu’une fois l’âge de 12 mois passé. A cet âge un pourcentage non négligeable de chiens seront donnés comme indemnes par la méthode classique alors qu’ils sont en réalité dysplasiques, les facteurs environnementaux leur ayant été favorables empêchant la traduction clinique et radiologique de la maladie au moment où les clichés de dépistage ont été réalisés. Et pourtant, dans les faits, ils sont porteurs des mauvais gènes et vont les mettre en circulation dans la race lors de la reproduction.
 Dès 1983, le professeur Gail Smith, de l’université de Pennsylvanie, décrivait une technique radiologique permettant, dès l’âge de 4 mois, d’établir un indice objectif, mesurable et donc chiffrable, de la laxité de la hanche chez le chien : la méthode Pennhip (Pennsylvania hip improvement program). Cette méthode utilise un dispositif appelé « distracteur » et mesure une valeur appelée « l’indice de distraction ». Cette procédure repose sur la réalisation, en une seule séance et sous anesthésie, de 3 clichés radiologiques pratiqués chez un chien couché sur le dos : un cliché standard permettant d’évaluer l’aspect anatomique de l’articulation, et deux clichés en position forcée, l’un en compression et l’autre en « distraction » avec le distracteur placé entre les pattes arrières du chien, ces deux derniers clichés permettant de visualiser le degré d’étirement maximum des ligaments de la hanche et ainsi, de mesurer l’indice de distraction.
Dès 1983, le professeur Gail Smith, de l’université de Pennsylvanie, décrivait une technique radiologique permettant, dès l’âge de 4 mois, d’établir un indice objectif, mesurable et donc chiffrable, de la laxité de la hanche chez le chien : la méthode Pennhip (Pennsylvania hip improvement program). Cette méthode utilise un dispositif appelé « distracteur » et mesure une valeur appelée « l’indice de distraction ». Cette procédure repose sur la réalisation, en une seule séance et sous anesthésie, de 3 clichés radiologiques pratiqués chez un chien couché sur le dos : un cliché standard permettant d’évaluer l’aspect anatomique de l’articulation, et deux clichés en position forcée, l’un en compression et l’autre en « distraction » avec le distracteur placé entre les pattes arrières du chien, ces deux derniers clichés permettant de visualiser le degré d’étirement maximum des ligaments de la hanche et ainsi, de mesurer l’indice de distraction.L’indice de distraction est calculé en mesurant le déplacement du centre de la tête fémorale entre le cliché en compression et celui en distraction. L’indice de distraction est mesuré séparément pour chaque hanche. Lorsque cet indice est de 0, l’emboitement de la tête fémorale dans le cotyle est parfait et il n’existe aucune hyper laxité. Un indice égal à 1 signe une luxation complète de la hanche. La laxité de la hanche mesurée par l’indice de distraction est un facteur prédictif de risque d’être atteint de DCF tout à fait fiable et ce, dès 4 mois, comme le prouvent différentes études dont l’une réalisée sur 15 742 chiens appartenant à différentes races prédisposées à cette maladie. Elle montre que le risque est en corrélation étroite avec la valeur de l’index. Ainsi, un chien dont l’indice est inférieur à 0,3 a un risque quasi nul d’être dysplasique alors qu’un chien dont l’indice dépasse 0,7 a un risque de 100% ! La procédure telle qu’elle est décrite, réduit à presque zéro le facteur lié à l’opérateur contrairement au dépistage classique. Elle a visiblement largement fait ses preuves aux Etats-Unis. Largement utilisée là-bas par les écoles de chiens guides d’aveugles sur leurs reproducteurs, ils ont réussi, sur une période de 8 ans, soit en moins de
5 générations, à abaisser leurs taux de dysplasie de 55% à 24% chez leurs Bergers Allemands et de 30% à 10% chez leurs Labradors.
Malheureusement, l’utilisation de cette procédure en dehors des Etats-Unis fut longtemps entravée car protégée par un brevet. Depuis peu, la procédure est tombée dans le domaine public et commence à se répandre y compris en France, mais sa reconnaissance par les instances cynophiles n’est pas encore d’actualité. Mais un jour viendra….. !
Traitement.
Nous l’avons dit, le meilleur traitement est préventif : dépistage des sujets atteints qui ne doivent pas être utilisés à la reproduction. Maîtrise des facteurs environnementaux chez tous les chiots pendant leur période de croissance.
La question du traitement curatif de cette pathologie ne se pose que chez un animal présentant des signes cliniques de la maladie c'est-à-dire une gêne fonctionnelle dans sa vie courante. La place respective du traitement médical et chirurgical est fonction de la gravité de l’atteinte clinique. Les techniques chirurgicales sont diverses et pouvant aller jusqu’à la mise en place d’une prothèse totale de la hanche. Sur ce point, mieux que quiconque, seul votre vétérinaire saura vous conseiller
Influence du cycle sexuel de la chienne sur le dépistage de la dysplasie de hanche.
Il est classique de croire que l’élévation du taux des œstrogènes chez la chienne pendant ses chaleurs était de nature à engendrer une fausse hyper laxité des ligaments de la hanche et donc de fausser le résultat de la radiographie de dépistage de la dysplasie de hanche et de croire que ce dépistage doit être fait à distance des chaleurs afin de ne pas s’exposer à voir les hanches de sa chienne être mal cotées à tort. Une étude américaine, réalisée par la même équipe que celle ayant mis au point la méthode Pennhip, datant du début des années 2000, semble bien mettre fin de façon claire à cette croyance. Les auteurs se sont intéressés à un groupe de 10 chiennes qu’ils ont suivies pendant toute la durée de leur cycle sexuel. Les différentes phases du cycle on été identifiées par l’étude répétée des frottis vaginaux. Pendant les chaleurs, des dosages hormonaux d’œstrogènes et de progestérone ont été réalisés. A chaque phase du cycle, un double dépistage de dysplasie a été effectué, par radiographie standard selon le protocole classique et par mesure de l’indice de distraction selon la méthode Pennhip. Les conclusions de cette première étude sont claires, les variations hormonales observées pendant les chaleurs ne modifient en rien le score de dysplasie que ce soit avec la méthode classique par radiographie standard ou le Pennhip.
Conclusions.
La dysplasie de hanche est une maladie génétique transmissible à la descendance. Source de destruction précoce plus ou moins sévère de l’articulation, les manifestations cliniques peuvent être très importantes et invalidantes. Il est donc indispensable de dépister les sujets atteints et de n’utiliser pour la reproduction que les sujets reconnus indemnes par le lecteur officiel de votre club de race. La méthode de dépistage actuellement admise par les instances cynophiles officielles, même si elle n’est pas parfaite, a cependant le mérite d’exister et de permettre de limiter la diffusion de cette maladie. Un nouveau mode de dépistage a vu le jour et se diffuse lentement chez nous. Il semble plus performant mais doit encore attendre sa reconnaissance officielle avant de pouvoir s’imposer.
Avec mes remerciements pour son aide précieuse au professeur J.P. Genevois de l’école vétérinaire de Lyon.
Source site Retriever Club de France
La dysplasie du coude
La dysplasie du coude
par le Dr Jean Marc Wurtz
Eclipsée par la dysplasie de la hanche, la dysplasie du coude est une pathologie mal connue et encore fortement sous-estimée alors que ses conséquences se révèlent être plus graves que celles de la dysplasie de la hanche. Son diagnostic est souvent difficile et posé tardivement à un stade où, malgré la mise en route d’un traitement adapté, la guérison complète est devenue impossible et source d’un handicap définitif.
C’est une affection de l’appareil ostéo-articulaire particulièrement répandues dans l’espèce canine qui, tout comme la dysplasie de la hanche, affecte préférentiellement les races de grande taille à croissance rapide.
La dysplasie résulte d’une malformation de l’un des composants de l’articulation. Une articulation est le point de rencontre entre deux ou plusieurs os, unis entre eux par des ligaments, et destinés à être mobiles l’un par rapport à l’autre. Elle est entourée d’un manchon protecteur appelé capsule articulaire. Les surfaces osseuses en contact sont appelées surfaces articulaires et sont recouvertes d’un cartilage destiné à faciliter les mouvements des os entre eux, l’ensemble baignant dans un liquide appelé liquide synovial et qui fait office de lubrifiant.
Lorsqu’une articulation est dysplasique, les mouvements qui s’y effectuent sont soumis à des contraintes mécaniques anormales qui conduisent à une usure prématurée puis une destruction des cartilages et des extrémités osseuses aboutissant à la constitution de lésions d’arthrose. Celle-ci se traduit cliniquement par une douleur et une boiterie handicapant plus ou moins l’animal.
Comme la dysplasie de la hanche, celle du coude est, au départ, une maladie génétique et est donc transmissible à la descendance. Le premier traitement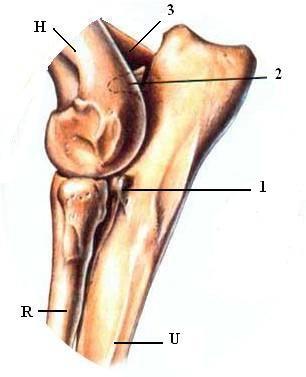 est donc préventif et consiste en un dépistage systématique des sujets atteints afin de les écarter des circuits de reproduction.
est donc préventif et consiste en un dépistage systématique des sujets atteints afin de les écarter des circuits de reproduction.
Généralités.
Le coude est l’articulation qui unit les os de l’avant-bras, le radius et l’ulna (ou cubitus), à celui du bras, l’humérus. La dysplasie du coude résulte d’un développement non harmonieux entre les différents os du coude aboutissant à la rupture de l’homogénéité du contact entre les surfaces articulaires de ces trois os.
H = Humérus
R = Radius
U = Ulna
1 = Processus coronoïde
2 = Processus anconé
3 = Incisure trochléaire
Cette maladie touche préférentiellement les grandes races et son incidence est actuellement évaluée à 19% chez les golden retrievers, 15% chez les labradors alors qu’elle est de 40% chez les bouviers bernois.
Le déterminisme génétique de cette affection est encore très mal connu mais est probablement multi génique. Tout comme pour la hanche, les gènes responsables sont, à ce jour, inconnus.
L’influence de l’alimentation et de l’exercice physique sur cette pathologie est encore mal précisée mais elle est réelle. De ce fait il faut donc parler comme pour la hanche de l’héritabilité de cette affection.
L’héritabilité résulte d’un calcul mathématique statistique et détermine, pour une race donnée, l’influence que peuvent avoir les facteurs environnementaux. Si l’héritabilité est de 0, la part génétique peut être totalement contrecarrée alors que si elle est de 1, les facteurs environnementaux ne peuvent avoir aucune influence. Sa valeur pour le coude n’est pas encore clairement établie mais semble tourner aux alentours de 0,3 – 0,4. Certaines études plaideraient en faveur d’une valeur plus élevée chez le mâle que chez la femelle.
Tout comme pour la hanche, le respect strict des règles hygiéno-diététiques en matière d’alimentation, de contrôle de la prise de poids et de l’exercice physique est fortement recommandé même chez des chiots issus de parents sains.
Le dépistage chez les sujets destinés à la reproduction est radiologique et consiste en trois clichés par coudes afin de rechercher, chez un chien adulte, des signes d’arthrose. La lecture des clichés permet de définir cinq stades :
En Allemagne par exemple, il est fortement déconseillé de faire reproduire des chiens à partir du Grade DC2 même unilatéral.
Trois grands mécanismes sont à l’origine de cette pathologie :
Pendant la période de croissance du chiot, radius et ulna se développent de façon parallèle et harmonieuse. La croissance des os est le fruit de l’activité de zones cartilagineuses situées au sein de l’os, les cartilages de croissance. Le défaut de fonctionnement de l’un des quatre cartilages de croissance présents au niveau de ces deux os fera que le radius et l’ulna n’auront pas la même taille. Donc, au lieu de présenter avec l’humérus une surface de contact unique et homogène, on retrouvera une surface séparée en deux par une « marche d’escalier », zone responsable du conflit mécanique à l’origine des lésions osseuses et cartilagineuses. Selon que le défaut de croissance touche le radius ou l’ulna, les lésions osseuses seront soit la fragmentation du processus coronoïde (radius trop court) soit la non union du processus anconé (cubitus trop court), ce deuxième mécanisme épargnant totalement nos races de retrievers.
La trochlée peut connaître un défaut de développement faisant que l’angle du V ne soit pas assez ouvert pour que l’ulna puisse s’y emboîter correctement. La friction mécanique qui en résulte aboutit selon les cas soit à la fragmentation du processus coronoïde soit à la non union du processus anconé soit à l’association des deux.
Il s’agit d’un défaut de structure de l’os à sa jonction avec le cartilage qui recouvre les surfaces articulaires (défaut d’ossification endochondrale). Il en résulte un épaississement et une fragilisation de ce cartilage qui subit alors des contraintes de cisaillement lors des mouvements de l’articulation. Le cartilage va tout d’abord se fissurer puis se décoller de l’os, le fragment décollé, une pastille pouvant atteindre la taille d’une pièce de 1€, flottant librement dans l’articulation. Ces lésions touchent surtout la partie interne de la trochlée.
Diagnostic.
Les signes cliniques se résument à une boiterie rebelle chez un chiot âgé de cinq à douze mois, réagissant mal aux traitements antalgiques et anti- inflammatoires. A l’examen de l’articulation, on retrouve une réduction de la mobilité et la mise en flexion du coude est douloureuse. L’efficacité imparfaite du traitement médical doit faire évoquer le diagnostique.
Les clichés radiographiques ne sont pas toujours très concluants surtout chez les jeunes chiots et il est clairement établi de nos jours que l’examen de référence pour affirmer le diagnostique est le scanner.
Une fois le diagnostic posé, quel traitement proposer ?
Le traitement médicamenteux seul donne des résultats significativement moins bons que la chirurgie. Le traitement idéal est l’association d’un geste chirurgical et d’un traitement médicamenteux.
Le traitement médicamenteux associe des substances antalgiques et des anti-inflammatoires. Une nouvelle gamme de molécules, les inhibiteurs de dégradation du cartilage, semble offrir des résultats très prometteurs. A ces médicaments viennent bien sûr s’ajouter les règles d’hygiène de vie habituelles avec au premier plan, la lutte contre l’excès de poids.
Le traitement chirurgical repose en premier lieu sur une arthroscopie du coude. Il s’agit d’un examen chirurgical, réalisé sous anesthésie générale qui consiste à visualiser l’intérieur de l’articulation à l’aide d’une petite caméra prolongée par un fin tube optique introduit au travers d’une toute petite incision. Cet examen permet de préciser le mécanisme et de faire le bilan précis des lésions. Par le biais d’une seconde petite incision, des instruments chirurgicaux peuvent être introduits dans l’articulation. On peu ainsi, au cours de la même anesthésie réaliser un premier traitement chirurgical et « nettoyer » l’articulation de tous les débris osseux et cartilagineux et de régulariser les surfaces articulaires. Dans certains cas, le geste chirurgical initial de « nettoyage » articulaire réalisé lors de l’arthroscopie est suffisant.
Une seconde intervention sera parfois nécessaire par la suite, plus importante. Cette arthroscopie permettra de le préciser et d’en informer les propriétaires du chien. Différentes techniques sont décrites dont le choix dépend du mécanisme de la dysplasie et des lésions existantes ainsi que des habitudes des équipes vétérinaires.
Les résultats actuels sont favorables dans seulement cinquante à soixante dix pour cent des cas. Principal responsable, la pose souvent tardive du diagnostic et donc la mise en œuvre tout aussi tardive de la chirurgie. Enfin, des modèles de prothèses totales de coude sont en cours d’évaluation aux Etats Unis.
D’après une conférences réalisée lors de la nationale d’élevage du retriever club de France à Sully sur Loire en septembre 2005 par le Dr. A. Guillemot, vétérinaire orthopédiste.
Avec l’aimable autorisation des conférenciers et l’aide précieuse, pour ce qui est de l’actualisation, du professeur J.P. Genevois de l’école vétérinaire de Lyon.
Source site Retriever Club de France
Eclipsée par la dysplasie de la hanche, la dysplasie du coude est une pathologie mal connue et encore fortement sous-estimée alors que ses conséquences se révèlent être plus graves que celles de la dysplasie de la hanche. Son diagnostic est souvent difficile et posé tardivement à un stade où, malgré la mise en route d’un traitement adapté, la guérison complète est devenue impossible et source d’un handicap définitif.
C’est une affection de l’appareil ostéo-articulaire particulièrement répandues dans l’espèce canine qui, tout comme la dysplasie de la hanche, affecte préférentiellement les races de grande taille à croissance rapide.
La dysplasie résulte d’une malformation de l’un des composants de l’articulation. Une articulation est le point de rencontre entre deux ou plusieurs os, unis entre eux par des ligaments, et destinés à être mobiles l’un par rapport à l’autre. Elle est entourée d’un manchon protecteur appelé capsule articulaire. Les surfaces osseuses en contact sont appelées surfaces articulaires et sont recouvertes d’un cartilage destiné à faciliter les mouvements des os entre eux, l’ensemble baignant dans un liquide appelé liquide synovial et qui fait office de lubrifiant.
Lorsqu’une articulation est dysplasique, les mouvements qui s’y effectuent sont soumis à des contraintes mécaniques anormales qui conduisent à une usure prématurée puis une destruction des cartilages et des extrémités osseuses aboutissant à la constitution de lésions d’arthrose. Celle-ci se traduit cliniquement par une douleur et une boiterie handicapant plus ou moins l’animal.
Comme la dysplasie de la hanche, celle du coude est, au départ, une maladie génétique et est donc transmissible à la descendance. Le premier traitement
 est donc préventif et consiste en un dépistage systématique des sujets atteints afin de les écarter des circuits de reproduction.
est donc préventif et consiste en un dépistage systématique des sujets atteints afin de les écarter des circuits de reproduction.Généralités.
Le coude est l’articulation qui unit les os de l’avant-bras, le radius et l’ulna (ou cubitus), à celui du bras, l’humérus. La dysplasie du coude résulte d’un développement non harmonieux entre les différents os du coude aboutissant à la rupture de l’homogénéité du contact entre les surfaces articulaires de ces trois os.
H = Humérus
R = Radius
U = Ulna
1 = Processus coronoïde
2 = Processus anconé
3 = Incisure trochléaire
Cette maladie touche préférentiellement les grandes races et son incidence est actuellement évaluée à 19% chez les golden retrievers, 15% chez les labradors alors qu’elle est de 40% chez les bouviers bernois.
Le déterminisme génétique de cette affection est encore très mal connu mais est probablement multi génique. Tout comme pour la hanche, les gènes responsables sont, à ce jour, inconnus.
L’influence de l’alimentation et de l’exercice physique sur cette pathologie est encore mal précisée mais elle est réelle. De ce fait il faut donc parler comme pour la hanche de l’héritabilité de cette affection.
L’héritabilité résulte d’un calcul mathématique statistique et détermine, pour une race donnée, l’influence que peuvent avoir les facteurs environnementaux. Si l’héritabilité est de 0, la part génétique peut être totalement contrecarrée alors que si elle est de 1, les facteurs environnementaux ne peuvent avoir aucune influence. Sa valeur pour le coude n’est pas encore clairement établie mais semble tourner aux alentours de 0,3 – 0,4. Certaines études plaideraient en faveur d’une valeur plus élevée chez le mâle que chez la femelle.
Tout comme pour la hanche, le respect strict des règles hygiéno-diététiques en matière d’alimentation, de contrôle de la prise de poids et de l’exercice physique est fortement recommandé même chez des chiots issus de parents sains.
Le dépistage chez les sujets destinés à la reproduction est radiologique et consiste en trois clichés par coudes afin de rechercher, chez un chien adulte, des signes d’arthrose. La lecture des clichés permet de définir cinq stades :
- Grade 0 = Coude normal, chien indemne.
- Grade SL = Stade limite, presque normal mais coude avec très légers défauts.
- Grade DC1 = Arthrose légère.
- Grade DC2 = Arthrose modérée et altération modérée du tissus osseux.
- Grade DC3 = Arthrose sévère et altération importante du tissus osseux.
En Allemagne par exemple, il est fortement déconseillé de faire reproduire des chiens à partir du Grade DC2 même unilatéral.
Trois grands mécanismes sont à l’origine de cette pathologie :
- La dysharmonie de croissance.
Pendant la période de croissance du chiot, radius et ulna se développent de façon parallèle et harmonieuse. La croissance des os est le fruit de l’activité de zones cartilagineuses situées au sein de l’os, les cartilages de croissance. Le défaut de fonctionnement de l’un des quatre cartilages de croissance présents au niveau de ces deux os fera que le radius et l’ulna n’auront pas la même taille. Donc, au lieu de présenter avec l’humérus une surface de contact unique et homogène, on retrouvera une surface séparée en deux par une « marche d’escalier », zone responsable du conflit mécanique à l’origine des lésions osseuses et cartilagineuses. Selon que le défaut de croissance touche le radius ou l’ulna, les lésions osseuses seront soit la fragmentation du processus coronoïde (radius trop court) soit la non union du processus anconé (cubitus trop court), ce deuxième mécanisme épargnant totalement nos races de retrievers.
- Le défaut d’ouverture de l’incisure trochléaire.
- La trochlée est la surface articulaire de l’humérus au niveau du coude. Elle possède une incisure, sorte de gouttière en V renversé dans laquelle s’emboîte et glisse la surface articulaire de l’ulna.
La trochlée peut connaître un défaut de développement faisant que l’angle du V ne soit pas assez ouvert pour que l’ulna puisse s’y emboîter correctement. La friction mécanique qui en résulte aboutit selon les cas soit à la fragmentation du processus coronoïde soit à la non union du processus anconé soit à l’association des deux.
- L’ostéochondrose disséquante.
Il s’agit d’un défaut de structure de l’os à sa jonction avec le cartilage qui recouvre les surfaces articulaires (défaut d’ossification endochondrale). Il en résulte un épaississement et une fragilisation de ce cartilage qui subit alors des contraintes de cisaillement lors des mouvements de l’articulation. Le cartilage va tout d’abord se fissurer puis se décoller de l’os, le fragment décollé, une pastille pouvant atteindre la taille d’une pièce de 1€, flottant librement dans l’articulation. Ces lésions touchent surtout la partie interne de la trochlée.
Diagnostic.
Les signes cliniques se résument à une boiterie rebelle chez un chiot âgé de cinq à douze mois, réagissant mal aux traitements antalgiques et anti- inflammatoires. A l’examen de l’articulation, on retrouve une réduction de la mobilité et la mise en flexion du coude est douloureuse. L’efficacité imparfaite du traitement médical doit faire évoquer le diagnostique.
Les clichés radiographiques ne sont pas toujours très concluants surtout chez les jeunes chiots et il est clairement établi de nos jours que l’examen de référence pour affirmer le diagnostique est le scanner.
Une fois le diagnostic posé, quel traitement proposer ?
Le traitement médicamenteux seul donne des résultats significativement moins bons que la chirurgie. Le traitement idéal est l’association d’un geste chirurgical et d’un traitement médicamenteux.
Le traitement médicamenteux associe des substances antalgiques et des anti-inflammatoires. Une nouvelle gamme de molécules, les inhibiteurs de dégradation du cartilage, semble offrir des résultats très prometteurs. A ces médicaments viennent bien sûr s’ajouter les règles d’hygiène de vie habituelles avec au premier plan, la lutte contre l’excès de poids.
Le traitement chirurgical repose en premier lieu sur une arthroscopie du coude. Il s’agit d’un examen chirurgical, réalisé sous anesthésie générale qui consiste à visualiser l’intérieur de l’articulation à l’aide d’une petite caméra prolongée par un fin tube optique introduit au travers d’une toute petite incision. Cet examen permet de préciser le mécanisme et de faire le bilan précis des lésions. Par le biais d’une seconde petite incision, des instruments chirurgicaux peuvent être introduits dans l’articulation. On peu ainsi, au cours de la même anesthésie réaliser un premier traitement chirurgical et « nettoyer » l’articulation de tous les débris osseux et cartilagineux et de régulariser les surfaces articulaires. Dans certains cas, le geste chirurgical initial de « nettoyage » articulaire réalisé lors de l’arthroscopie est suffisant.
Une seconde intervention sera parfois nécessaire par la suite, plus importante. Cette arthroscopie permettra de le préciser et d’en informer les propriétaires du chien. Différentes techniques sont décrites dont le choix dépend du mécanisme de la dysplasie et des lésions existantes ainsi que des habitudes des équipes vétérinaires.
Les résultats actuels sont favorables dans seulement cinquante à soixante dix pour cent des cas. Principal responsable, la pose souvent tardive du diagnostic et donc la mise en œuvre tout aussi tardive de la chirurgie. Enfin, des modèles de prothèses totales de coude sont en cours d’évaluation aux Etats Unis.
D’après une conférences réalisée lors de la nationale d’élevage du retriever club de France à Sully sur Loire en septembre 2005 par le Dr. A. Guillemot, vétérinaire orthopédiste.
Avec l’aimable autorisation des conférenciers et l’aide précieuse, pour ce qui est de l’actualisation, du professeur J.P. Genevois de l’école vétérinaire de Lyon.
Source site Retriever Club de France
Les pathologies oculaires
Les pathologies oculaires
Pathologies de la rétine
Atrophie progressive de la rétine (APR)
Les atrophies rétiniennes sont des maladies des photorécepteurs.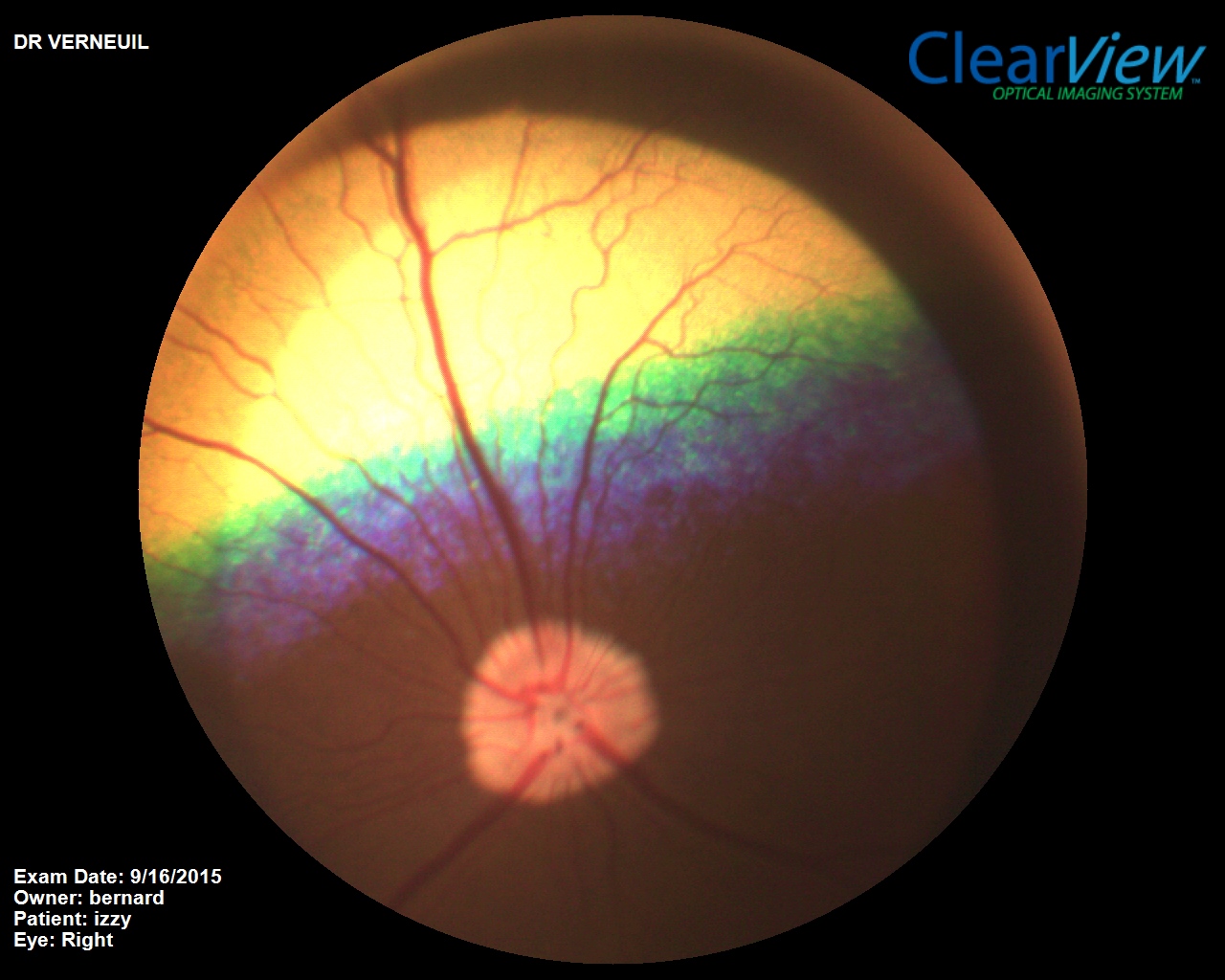
Les cônes et les bâtonnets dégénèrent et meurent, ainsi, la lumière n’est plus transformée en signal électrique et la vision est donc affectée. Les bâtonnets qui sont les cellules de la rétine responsables de la vision de nuit, sont les premiers éléments à être affectés par cette maladie ; ainsi l’animal va commencer par buter dans les objets dans la pénombre ou le noir (perte de la vision de nuit). Les cônes, responsables de la vision en couleur et de la vision de jour dégénèrent plus lentement.
L 'installation de cette pathologie est progressive si bien que le sujet peut s’adapter et avoir un comportement normal au début de la maladie. Il est possible que la dégénérescence des cônes et des bâtonnets prenne des mois ou des années avant d’être vraiment marquée. Néanmoins cette pathologie conduit toujours à la cécité.
Il existe deux formes d’atrophie de la rétine, la forme généralisée et la forme centrale.
La forme généralisée concerne préférentiellement les curly, les chessy, les golden, les labrador et les nova ; c'est une pathologie héréditaire, monogénique, autosomique récessive. Plusieurs mutations ont été identifiées, d'autres sont à ce jour encore inconnues.
La forme centrale concerne les flat. Cette forme serait héréditaire, autosomique dominante.
Le diagnostic de l’atrophie progressive de la rétine se fait par un examen direct du fond de l’œil à l’aide d’un instrument appelé un ophtalmoscope et aussi par un électrorétinogramme (ERG).
Des tests génétiques de dépistage sont également disponibles pour les mutations connues. Mais ces tests étant spécifiques a une mutation donnée, ils ne dispensent pas d'un examen oculaire régulier.
Dysplasie rétinienne
La dysplasie rétinienne est une pathologie congénitale, focale ou diffuse, due à une anomalie de la différentiation des couches rétiniennes. Elle est caractérisée par la présence de plis, rosettes ou stries, représentant une élévation rétinienne, c'est-à-dire la séparation de la neuro-rétine de l’épithélium pigmentaire sous jacent, sur le fond d’œil.
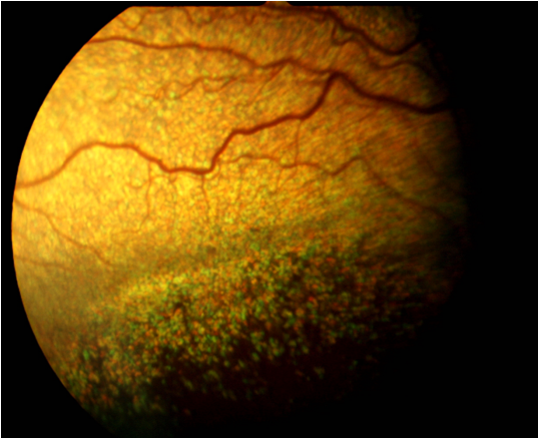 L’architecture de la rétine est modifiée de manière irréversible. L’anomalie est d’autant moins péjorative qu’elle est limitée en surface.
L’architecture de la rétine est modifiée de manière irréversible. L’anomalie est d’autant moins péjorative qu’elle est limitée en surface.
Cette maladie n'est pas progressive ; c'est une affection congénitale et les chiots qui naissent avec. Un diagnostic précoce est donc possible dès l'age de 6 à 8 semaines de vie. Quoiqu'il en soit du fait de la taille des yeux qui est petite et de la turbulence des chiots pendant l'examen, un contrôle à 6 mois permettra à l'ophtalmologiste de mieux examiner le fond de l'œil.
La pathologie peut évoluer vers un décollement de rétine et conduire à la cécité. Les formes mineures n'évoluent pas et sont sans conséquences sur la vision de l'individu.
La dysplasie est souvent associée à d’autres anomalies : AOC, hypoplasie du nerf optique,…
La dysplasie rétinienne est le plus souvent génétique même si des infections prénatales peuvent y conduire. Le mode de transmission n'a pas été déterminé mais une transmission autosomale récessive est suspectée.
Hypoplasie choroïdienne (ou Anomalie de l’œil du Colley)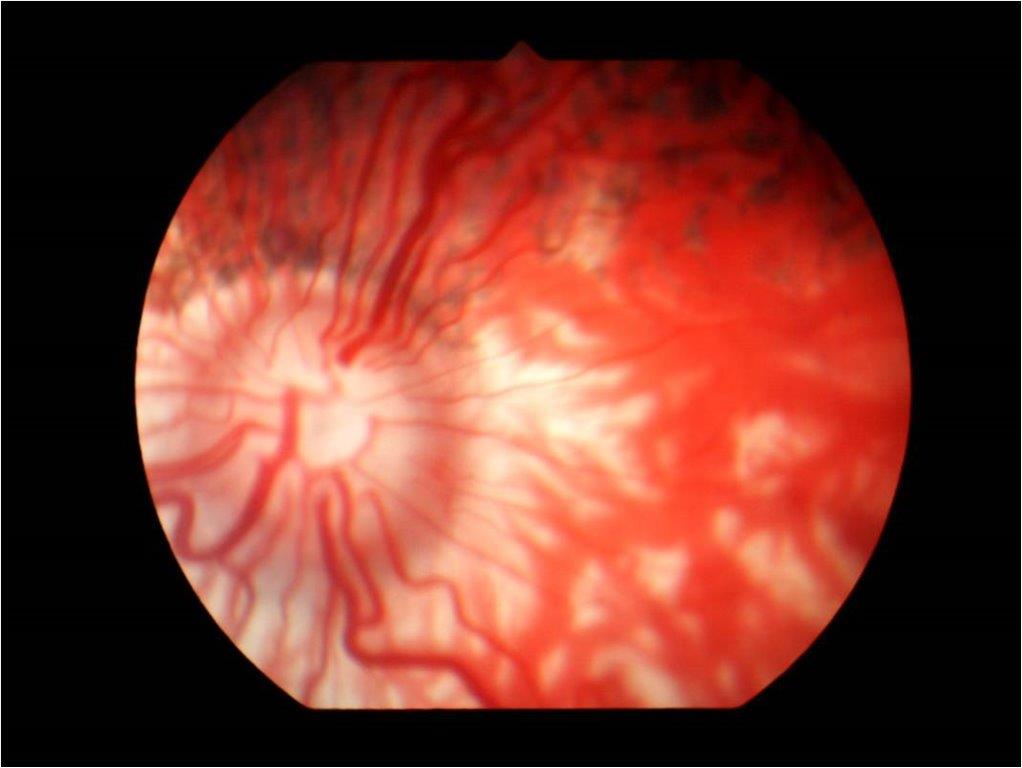
Pathologie pouvant toucher les Nova Scotia Duck Tolling Retriever. Il s'agit d'une anomalie du développement de la choroïde, d'origine génétique, observable au fond d’œil et caractérisée par une zone dépigmentée. La vision du chien n'est pas altérée dans les formes mineures. Elle peut se compliquer d'un décollement de rétine au niveau de la zone d'hypoplasie. Le diagnostic se fait à l'âge de 7 à 8 semaines. L'hypoplasie peut par la suite être masquée à l'âge adulte, d’où l'intérêt du diagnostic précoce.
Persistance de la membrane pupillaire
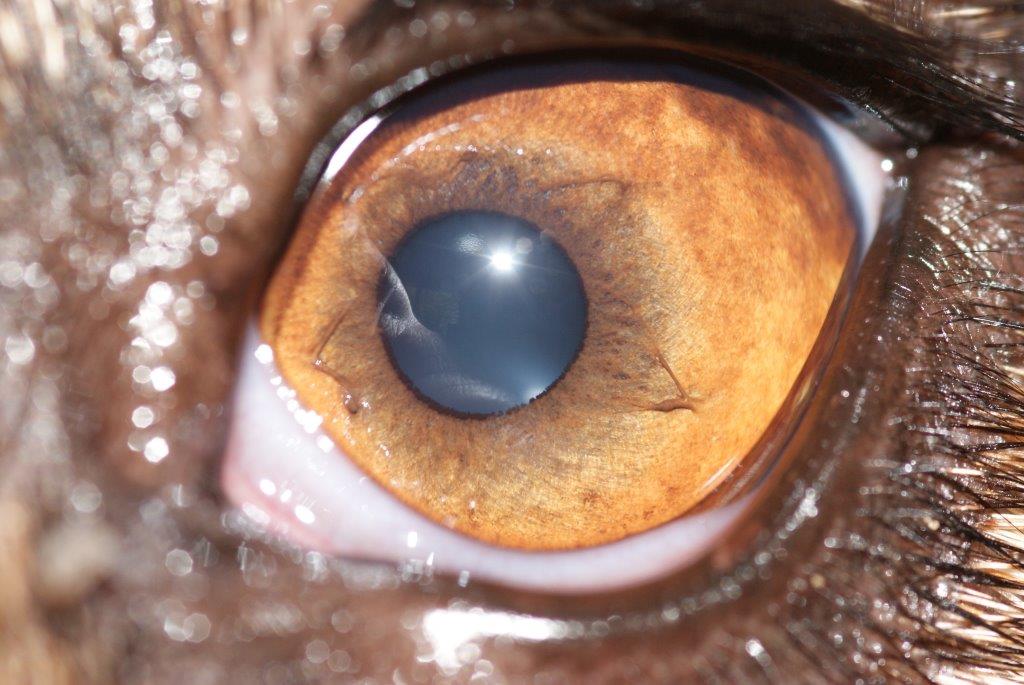
Affection congénitale correspondant à la persistance anormale de fibres de la membrane pupillaire attachées à la face postérieure de la cornée. La localisation est variable.
Gonio-dysplasie
Il s'agît d'une anomalie présumée héréditaire de l'angle irido-cornéen *, appelée dysplasie du ligament pectiné. Le ligament pectiné se trouve épaissi.
Les modifications de l'angle iridocornéen sont réparties en 3 stades :
- fibra latae
- laminae
- occlusion
Cette pathologie pourrait jouer un rôle dans l'apparition du glaucome primaire, bien qu'aucune étude n'ait montré le rapport de cause à effet entre les deux pathologies.
*L’angle irido-cornéen correspond à la voie principale d’évacuation de l’humeur aqueuse (le liquide qui remplit la partie antérieure de l’œil) et contient le réseau trabéculaire et la fente ciliaire.
Glaucome
Le glaucome se définit chez le chien par une augmentation de la pression intraoculaire (PIO) entraînant une destruction progressive des structures oculaires et une altération de leur fonction conduisant à la cécité. Dans certaines races cette pathologie est héréditaire.
Cataractes
On définit une cataracte comme toute opacité congénitale ou acquise du cristallin. L’opacité est évolutive ou non. Elle est caractérisée cliniquement par :
• sa localisation dans le cristallin : capsulaire, corticale ou nucléaire
• sa topographie : espace antérieur, postérieur, polaire ou cortical
• son moment d’apparition : congénitale ou acquise, précoce ou tardive
Les cataractes
Les cataractes congénitales :
Bien que présentes à la naissance, elles ne sont bien souvent diagnostiquées qu’à l’âge de 8 semaines voire plus. Elles sont généralement isolées. Ce sont généralement des cataractes polaires.
Les répercussions sur la vision dépendent de leur extension et de leur localisation.
Mais les cataractes congénitales ne sont pas obligatoirement héréditaires, peuvent intervenir des facteurs infectieux ou toxiques.
Les cataractes héréditaires juvéniles :
Elles apparaissent chez le jeune chien (3 à 6 mois) et progressent jusqu’à devenir totales à l’age de 2 ans.
La cataracte héréditaire spécifique aux Retrievers est une cataracte postérieure souvent qualifiée de sous-capsulaire triangulaire postérieure dans sa forme typique. Elle peut évoluer, le cristallin devenant alors blanc dans sa totalité.
L’œil n'est plus voyant. Elle se transmet sur le mode dominant à pénétrance incomplète. C'est à dire qu'elle peut ne pas s'exprimer ou s'exprimer de façon très discrète.
Le diagnostic des cataractes héréditaires est établi d’après l’âge d’apparition de la cataracte et grâce à l’aspect bilatéral, mais irrégulièrement symétrique, de lésions à prédominance corticale postérieure. Il suppose l’absence de toute affection inflammatoire, métabolique, nutritionnelle ou toxique qui pourrait induire une cataracte chez le jeune sujet. L’évolution est variable dans le temps.
Ectropion – Entropion
Il s’agit dans les deux cas d’une disparité entre la taille du globe et la longueur de la paupière, d’où une déformation de la fente palpébrale. Dans l'entropion, la paupière est enroulée contre la surface de l’œil, tandis que dans l'ectropion, la paupière pend vers l'extérieur exposant la partie inférieure de la cornée.
Trichiasis - Distichiasis
Pathologies de l'implantation ciliaire : le trichiasis est caractérisé par la déviation de cils normaux ou surnuméraires vers la cornée. Le distichiasis consiste en une double rangée d’implantation des cils.
Tableau récapitulatif des races de retriever
Atrophie de RétineCataracte
ChesapeakeUne mutation connue : APR PRCD
Autosomique récessifapparaît vers 3 ans,
Transmission autosomique dominante
l’opacité est polaire et postérieure
CurlycoatedUne mutation connue : APR Cord1
Autosomique récessif
Age de survenue 3 à 5 ansEn général bilatérale
sous-capsulaire corticale antérieure ou capsulaire postérieure
apparition entre 5 et 6 ans (mais peut apparaître vers l'age de 2 ans et évoluer lentement)
FlatcoatedAtrophie centrale de rétine
Apparition vers 3 ans
Pas de mutation connue
Mode de transmission inconnuApparition vers 4 ans
Mode de transmission inconnu
Golden3 mutations identifiées : APR PRCD, GR PRA1 et GR PRA2
apparition en général entre 5 et 7 ans ( mais possible dès 3 ans)Transmission autosomique dominante
Apparition vers 6-8 mois pour la cataracte juvénile
Localisation Polaire postérieure
LabradorUne mutation identifiée APR PRCD (d'autres suspectées)
Autosomique récessif
apparition entre 5 et 7 ansTransmission autosomique dominante
Apparition vers 6-8 mois pour la cataracte juvénile
Localisation Polaire postérieure
Nova ScotiaUne mutation identifiée APR PRCD
Autosomique récessif
apparition entre 5 et 7 ans
Remerciements au Dr Verneuil, AFEP_MHOC, pour son aide à la rédaction de ce document et pour les illustrations.
Source site Retriever Club de France
Atrophie progressive de la rétine (APR)
Les atrophies rétiniennes sont des maladies des photorécepteurs.

Les cônes et les bâtonnets dégénèrent et meurent, ainsi, la lumière n’est plus transformée en signal électrique et la vision est donc affectée. Les bâtonnets qui sont les cellules de la rétine responsables de la vision de nuit, sont les premiers éléments à être affectés par cette maladie ; ainsi l’animal va commencer par buter dans les objets dans la pénombre ou le noir (perte de la vision de nuit). Les cônes, responsables de la vision en couleur et de la vision de jour dégénèrent plus lentement.
L 'installation de cette pathologie est progressive si bien que le sujet peut s’adapter et avoir un comportement normal au début de la maladie. Il est possible que la dégénérescence des cônes et des bâtonnets prenne des mois ou des années avant d’être vraiment marquée. Néanmoins cette pathologie conduit toujours à la cécité.
Il existe deux formes d’atrophie de la rétine, la forme généralisée et la forme centrale.
La forme généralisée concerne préférentiellement les curly, les chessy, les golden, les labrador et les nova ; c'est une pathologie héréditaire, monogénique, autosomique récessive. Plusieurs mutations ont été identifiées, d'autres sont à ce jour encore inconnues.
La forme centrale concerne les flat. Cette forme serait héréditaire, autosomique dominante.
Le diagnostic de l’atrophie progressive de la rétine se fait par un examen direct du fond de l’œil à l’aide d’un instrument appelé un ophtalmoscope et aussi par un électrorétinogramme (ERG).
Des tests génétiques de dépistage sont également disponibles pour les mutations connues. Mais ces tests étant spécifiques a une mutation donnée, ils ne dispensent pas d'un examen oculaire régulier.
Dysplasie rétinienne
La dysplasie rétinienne est une pathologie congénitale, focale ou diffuse, due à une anomalie de la différentiation des couches rétiniennes. Elle est caractérisée par la présence de plis, rosettes ou stries, représentant une élévation rétinienne, c'est-à-dire la séparation de la neuro-rétine de l’épithélium pigmentaire sous jacent, sur le fond d’œil.
 L’architecture de la rétine est modifiée de manière irréversible. L’anomalie est d’autant moins péjorative qu’elle est limitée en surface.
L’architecture de la rétine est modifiée de manière irréversible. L’anomalie est d’autant moins péjorative qu’elle est limitée en surface.Cette maladie n'est pas progressive ; c'est une affection congénitale et les chiots qui naissent avec. Un diagnostic précoce est donc possible dès l'age de 6 à 8 semaines de vie. Quoiqu'il en soit du fait de la taille des yeux qui est petite et de la turbulence des chiots pendant l'examen, un contrôle à 6 mois permettra à l'ophtalmologiste de mieux examiner le fond de l'œil.
La pathologie peut évoluer vers un décollement de rétine et conduire à la cécité. Les formes mineures n'évoluent pas et sont sans conséquences sur la vision de l'individu.
La dysplasie est souvent associée à d’autres anomalies : AOC, hypoplasie du nerf optique,…
La dysplasie rétinienne est le plus souvent génétique même si des infections prénatales peuvent y conduire. Le mode de transmission n'a pas été déterminé mais une transmission autosomale récessive est suspectée.
Hypoplasie choroïdienne (ou Anomalie de l’œil du Colley)

Pathologie pouvant toucher les Nova Scotia Duck Tolling Retriever. Il s'agit d'une anomalie du développement de la choroïde, d'origine génétique, observable au fond d’œil et caractérisée par une zone dépigmentée. La vision du chien n'est pas altérée dans les formes mineures. Elle peut se compliquer d'un décollement de rétine au niveau de la zone d'hypoplasie. Le diagnostic se fait à l'âge de 7 à 8 semaines. L'hypoplasie peut par la suite être masquée à l'âge adulte, d’où l'intérêt du diagnostic précoce.
- Anomalies du segment antérieur
Persistance de la membrane pupillaire

Affection congénitale correspondant à la persistance anormale de fibres de la membrane pupillaire attachées à la face postérieure de la cornée. La localisation est variable.
Gonio-dysplasie
Il s'agît d'une anomalie présumée héréditaire de l'angle irido-cornéen *, appelée dysplasie du ligament pectiné. Le ligament pectiné se trouve épaissi.
Les modifications de l'angle iridocornéen sont réparties en 3 stades :
- fibra latae
- laminae
- occlusion
Cette pathologie pourrait jouer un rôle dans l'apparition du glaucome primaire, bien qu'aucune étude n'ait montré le rapport de cause à effet entre les deux pathologies.
*L’angle irido-cornéen correspond à la voie principale d’évacuation de l’humeur aqueuse (le liquide qui remplit la partie antérieure de l’œil) et contient le réseau trabéculaire et la fente ciliaire.
Glaucome
Le glaucome se définit chez le chien par une augmentation de la pression intraoculaire (PIO) entraînant une destruction progressive des structures oculaires et une altération de leur fonction conduisant à la cécité. Dans certaines races cette pathologie est héréditaire.
Cataractes
On définit une cataracte comme toute opacité congénitale ou acquise du cristallin. L’opacité est évolutive ou non. Elle est caractérisée cliniquement par :
• sa localisation dans le cristallin : capsulaire, corticale ou nucléaire
• sa topographie : espace antérieur, postérieur, polaire ou cortical
• son moment d’apparition : congénitale ou acquise, précoce ou tardive
Les cataractes
Les cataractes congénitales :
Bien que présentes à la naissance, elles ne sont bien souvent diagnostiquées qu’à l’âge de 8 semaines voire plus. Elles sont généralement isolées. Ce sont généralement des cataractes polaires.
Les répercussions sur la vision dépendent de leur extension et de leur localisation.
Mais les cataractes congénitales ne sont pas obligatoirement héréditaires, peuvent intervenir des facteurs infectieux ou toxiques.
Les cataractes héréditaires juvéniles :
Elles apparaissent chez le jeune chien (3 à 6 mois) et progressent jusqu’à devenir totales à l’age de 2 ans.
La cataracte héréditaire spécifique aux Retrievers est une cataracte postérieure souvent qualifiée de sous-capsulaire triangulaire postérieure dans sa forme typique. Elle peut évoluer, le cristallin devenant alors blanc dans sa totalité.
L’œil n'est plus voyant. Elle se transmet sur le mode dominant à pénétrance incomplète. C'est à dire qu'elle peut ne pas s'exprimer ou s'exprimer de façon très discrète.
Le diagnostic des cataractes héréditaires est établi d’après l’âge d’apparition de la cataracte et grâce à l’aspect bilatéral, mais irrégulièrement symétrique, de lésions à prédominance corticale postérieure. Il suppose l’absence de toute affection inflammatoire, métabolique, nutritionnelle ou toxique qui pourrait induire une cataracte chez le jeune sujet. L’évolution est variable dans le temps.
- Anomalies des annexes
Ectropion – Entropion
Il s’agit dans les deux cas d’une disparité entre la taille du globe et la longueur de la paupière, d’où une déformation de la fente palpébrale. Dans l'entropion, la paupière est enroulée contre la surface de l’œil, tandis que dans l'ectropion, la paupière pend vers l'extérieur exposant la partie inférieure de la cornée.
Trichiasis - Distichiasis
Pathologies de l'implantation ciliaire : le trichiasis est caractérisé par la déviation de cils normaux ou surnuméraires vers la cornée. Le distichiasis consiste en une double rangée d’implantation des cils.
Tableau récapitulatif des races de retriever
Atrophie de RétineCataracte
ChesapeakeUne mutation connue : APR PRCD
Autosomique récessifapparaît vers 3 ans,
Transmission autosomique dominante
l’opacité est polaire et postérieure
CurlycoatedUne mutation connue : APR Cord1
Autosomique récessif
Age de survenue 3 à 5 ansEn général bilatérale
sous-capsulaire corticale antérieure ou capsulaire postérieure
apparition entre 5 et 6 ans (mais peut apparaître vers l'age de 2 ans et évoluer lentement)
FlatcoatedAtrophie centrale de rétine
Apparition vers 3 ans
Pas de mutation connue
Mode de transmission inconnuApparition vers 4 ans
Mode de transmission inconnu
Golden3 mutations identifiées : APR PRCD, GR PRA1 et GR PRA2
apparition en général entre 5 et 7 ans ( mais possible dès 3 ans)Transmission autosomique dominante
Apparition vers 6-8 mois pour la cataracte juvénile
Localisation Polaire postérieure
LabradorUne mutation identifiée APR PRCD (d'autres suspectées)
Autosomique récessif
apparition entre 5 et 7 ansTransmission autosomique dominante
Apparition vers 6-8 mois pour la cataracte juvénile
Localisation Polaire postérieure
Nova ScotiaUne mutation identifiée APR PRCD
Autosomique récessif
apparition entre 5 et 7 ans
Remerciements au Dr Verneuil, AFEP_MHOC, pour son aide à la rédaction de ce document et pour les illustrations.
Source site Retriever Club de France
L'Ichtyose chez le Golden Retriever
L’Ichtyose chez le Golden Retriever
Définitions et généralités.
L’Ichtyose est une maladie de la peau présente chez l’homme ainsi que dans diverses espèces animales dont le chien. Cette maladie est incurable et seul un traitement symptomatique peut être proposé, celui-ci devant être conduit pendant toute la durée de vie du chien.
L’Ichtyose est une génodermatose c'est-à-dire une maladie de l’épiderme à caractère héréditaire et donc transmissible à la descendance.. L’intensité des signes cliniques et l’étendue des lésions sur le corps sont très variables.
La peau est la barrière de protection de l’organisme et sert de rempart contre les agents pathogènes venus de l’extérieur et principalement, les agents infectieux. Elle est constituée de différentes couches dont la plus superficielle est l’épiderme constitué à 85% de cellules riches en kératine, les Kératocytes, qui forment ce qu’on nomme la couche cornée. L’ichtyose perturbe le cycle naturel de renouvellement des cellules de l’épiderme. Elle modifie la structure de la couche cornée sur une partie plus ou moins étendue du corps. On parle d’hyper kératinisation. Ce phénomène s’accompagne d’une accentuation anormale de la desquamation cutanée et d’un épaississement de la peau. Les couches profondes de la peau peuvent être atteintes d’inflammation. La peau ne peut plus remplir son rôle de barrière protectrice et l’entrée de germes pathologique est favorisée pouvant, dans certaines formes graves, compliquer la maladie par des infections cutanées plus ou moins sévères pouvant parfois tourner à la chronicité.
Diagnostic et signes cliniques.
Chez le chien, la maladie se déclare chez les chiots âgés de quelques mois et dure toute la vie de l’animal. Chez les retrievers, si de très rares cas ont été décrits chez le Labrador, c’est principalement le Golden qui est concerné.
Les formes non épidermolytiques : Tout le corps, où une grande partie, est recouvert de grandes squames, de couleur variable, évoquant des écailles de poisson. Il peut s’y mélanger des débris séborrhéiques conférant alors à l’animal une odeur plus ou moins forte. La surface de la peau est rugueuse, irrégulière, sèche et cassante, parfois douloureuse. Germes et champignons aiment à se nicher dans les irrégularités de cette peau malade. Au cours de ses déplacements, le chien laisse derrière lui des trainées de squames. Il est possible d’observer des zones d’hyperkératisation au niveau de la truffe et des coussinets plantaires. Ces zones sont alors épaissies, leur aspect est semblable à de la corne et des complications infectieuses peuvent également s’y développer. Certaines zones du corps peuvent parfois être le siège d’une alopécie, c'est-à-dire qu’elles sont dépourvues de poils. L’importance de ces signes cliniques est très variable d’un animal à l’autre.
Les formes épidermolytiques : Elles sont beaucoup plus sévères mais ne semblent pas toucher, pour l’heure, la race Golden retriever.
La réalisation d’une biopsie de la peau et son examen microscopique au laboratoire permet de confirmer le diagnostique.


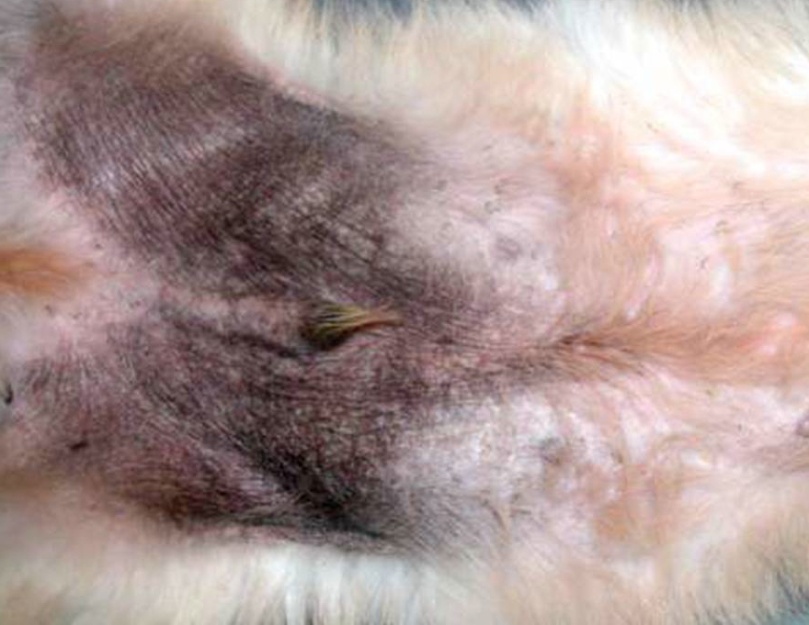
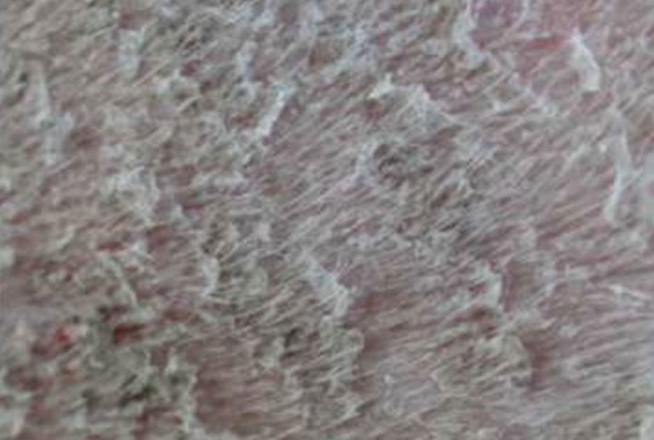
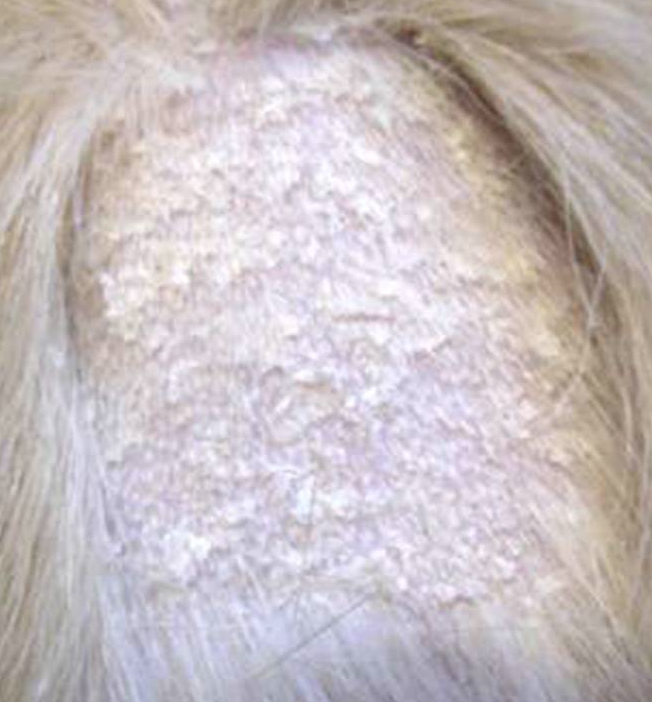
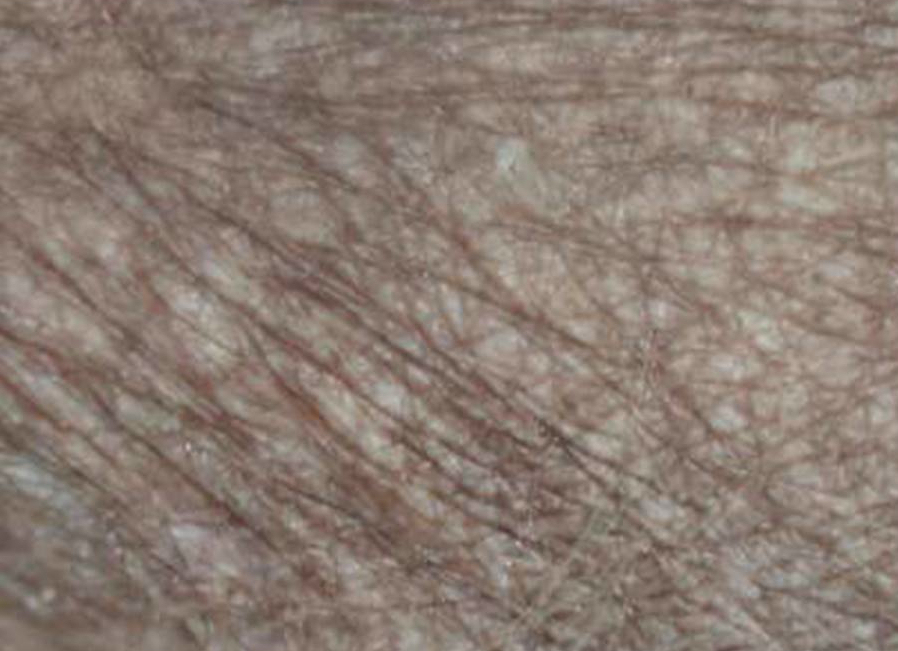
En haut à gauche, gros plan de squames et à droite, squames pris dans le pelage. Au milieu, squames et hyper pigmentation de la peau de l’abdomen, chez un chiot à gauche, un adulte à droite. En bas, hyperkératose à gauche et peau plissée « en peau d’éléphant » à droite chez des chiots.
Traitement.
A ce jour, l’Ichtyose est une maladie incurable. Il n’existe donc aucun traitement capable de la guérir. Seul un traitement symptomatique est possible c'est-à-dire, un traitement dont le seul but est de réduire les manifestations de la maladie et d’améliorer le confort de l’animal et le quotidien de la famille humaine chez qui il vit.
Il doit être maintenu tout au long de la vie du chien
Il associe :
Maladie génétique.
L’ichtyose canine est une maladie génétique, héréditaire et donc transmissible à la descendance.
Le gène responsable a été identifié chez le Golden Retriever et son mode de transmission est de type autosomique récessif.
Un test de dépistage est disponible.
On distingue donc trois catégories de chiens en fonction de leur génotype :
Quelques chiffres.
En France, selon les séries, on estime le pourcentage de Goldens homozygotes sains entre 16,8% et 29,8%, celui des hétérozygotes (porteurs sains) entre 39,4% et 43,3% et enfin celui des homozygotes mutés (chiens atteints de la maladie) entre 43,9% et 26,9%.
Source site Retriever Club de France
L’Ichtyose est une maladie de la peau présente chez l’homme ainsi que dans diverses espèces animales dont le chien. Cette maladie est incurable et seul un traitement symptomatique peut être proposé, celui-ci devant être conduit pendant toute la durée de vie du chien.
L’Ichtyose est une génodermatose c'est-à-dire une maladie de l’épiderme à caractère héréditaire et donc transmissible à la descendance.. L’intensité des signes cliniques et l’étendue des lésions sur le corps sont très variables.
La peau est la barrière de protection de l’organisme et sert de rempart contre les agents pathogènes venus de l’extérieur et principalement, les agents infectieux. Elle est constituée de différentes couches dont la plus superficielle est l’épiderme constitué à 85% de cellules riches en kératine, les Kératocytes, qui forment ce qu’on nomme la couche cornée. L’ichtyose perturbe le cycle naturel de renouvellement des cellules de l’épiderme. Elle modifie la structure de la couche cornée sur une partie plus ou moins étendue du corps. On parle d’hyper kératinisation. Ce phénomène s’accompagne d’une accentuation anormale de la desquamation cutanée et d’un épaississement de la peau. Les couches profondes de la peau peuvent être atteintes d’inflammation. La peau ne peut plus remplir son rôle de barrière protectrice et l’entrée de germes pathologique est favorisée pouvant, dans certaines formes graves, compliquer la maladie par des infections cutanées plus ou moins sévères pouvant parfois tourner à la chronicité.
Diagnostic et signes cliniques.
Chez le chien, la maladie se déclare chez les chiots âgés de quelques mois et dure toute la vie de l’animal. Chez les retrievers, si de très rares cas ont été décrits chez le Labrador, c’est principalement le Golden qui est concerné.
Les formes non épidermolytiques : Tout le corps, où une grande partie, est recouvert de grandes squames, de couleur variable, évoquant des écailles de poisson. Il peut s’y mélanger des débris séborrhéiques conférant alors à l’animal une odeur plus ou moins forte. La surface de la peau est rugueuse, irrégulière, sèche et cassante, parfois douloureuse. Germes et champignons aiment à se nicher dans les irrégularités de cette peau malade. Au cours de ses déplacements, le chien laisse derrière lui des trainées de squames. Il est possible d’observer des zones d’hyperkératisation au niveau de la truffe et des coussinets plantaires. Ces zones sont alors épaissies, leur aspect est semblable à de la corne et des complications infectieuses peuvent également s’y développer. Certaines zones du corps peuvent parfois être le siège d’une alopécie, c'est-à-dire qu’elles sont dépourvues de poils. L’importance de ces signes cliniques est très variable d’un animal à l’autre.
Les formes épidermolytiques : Elles sont beaucoup plus sévères mais ne semblent pas toucher, pour l’heure, la race Golden retriever.
La réalisation d’une biopsie de la peau et son examen microscopique au laboratoire permet de confirmer le diagnostique.






En haut à gauche, gros plan de squames et à droite, squames pris dans le pelage. Au milieu, squames et hyper pigmentation de la peau de l’abdomen, chez un chiot à gauche, un adulte à droite. En bas, hyperkératose à gauche et peau plissée « en peau d’éléphant » à droite chez des chiots.
Traitement.
A ce jour, l’Ichtyose est une maladie incurable. Il n’existe donc aucun traitement capable de la guérir. Seul un traitement symptomatique est possible c'est-à-dire, un traitement dont le seul but est de réduire les manifestations de la maladie et d’améliorer le confort de l’animal et le quotidien de la famille humaine chez qui il vit.
Il doit être maintenu tout au long de la vie du chien
Il associe :
- Un brossage quotidien et maintenir le poil court pour faciliter l’hydratation et le nettoyage de la peau.
- L’application de shampoings spéciaux une à deux fois par semaine. Ils peuvent être associés à l’application de lotions à base d’acides gras.
- L’apport de compléments en acides gras essentiels dans l’alimentation semble très intéressant.
- Le traitement des lésions associées notamment infectieuses.
Maladie génétique.
L’ichtyose canine est une maladie génétique, héréditaire et donc transmissible à la descendance.
Le gène responsable a été identifié chez le Golden Retriever et son mode de transmission est de type autosomique récessif.
Un test de dépistage est disponible.
On distingue donc trois catégories de chiens en fonction de leur génotype :
- Les sujets homozygotes sains qui ne sont pas atteints par la maladie et ne portent pas le gène responsable. Ils ne transmettront rien de néfaste à leur descendance.
- Les sujets hétérozygotes sont dits porteurs sains car ils ne sont pas malades mais sont porteurs du gène responsable qui reste muet, mais qu’ils peuvent disséminer dans la race. S’ils sont utilisés à la reproduction, ils ne doivent en toute logique être croisés qu’avec des homozygotes sains.
- Les sujets homozygotes mutés sont atteints de la maladie et présentent des signes cliniques. Compte tenu du pourcentage élevé de chiens homozygotes mutés, ce dont attestent les statistiques qui nous ont été fournies par le laboratoire Antagène, et soucieux de ne pas appauvrir le pool génétique, nous considérons que si l’on décide, après mûre réflexion, d’utiliser à la reproduction un tel chien malgré sa maladie, il est impératif qu'il ne soit croisé qu'avec un sujet sain non porteur. De cette façon, aucun chiot malade ne sera produit et le RCF invite les éleveurs à ne garder dans l'avenir que les sujets homozygotes sains et hétérozygotes mutés.
Quelques chiffres.
En France, selon les séries, on estime le pourcentage de Goldens homozygotes sains entre 16,8% et 29,8%, celui des hétérozygotes (porteurs sains) entre 39,4% et 43,3% et enfin celui des homozygotes mutés (chiens atteints de la maladie) entre 43,9% et 26,9%.
Source site Retriever Club de France





